| | A, B | due sostanze distinte |
| | 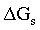
| variazione di energia libera. |
| | 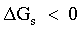
| il processo di solubilizzazione avviene spontaneamente. |
| | 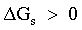
| A e B resteranno come fasi distinte |
| | 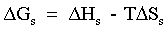
| |
| | 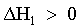
| 1) le particelle del soluto A debbono essere allontanate le une dalle altre. |
| | 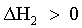
| 2) le particelle del solvente B debbono essere allontanate le une dalle altre. |
| | 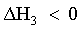
| 3) le particelle di A e di B si avvicinano attraendosi. |
| (65) | 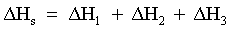 | Variazione complessiva di entalpia del processo. |
| | 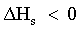 | Il processo è esotermico. |
| | 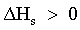 | Il processo è endotermico. |
| | 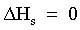 | Il processo è atermico. |
| | VA | Volume di un dato recipiente contenente il gas ideale A. |
| | nA | Numero di moli del gas ideale A contenuto nel recipiente VA. |
| | VB | Volume di un dato recipiente contenente il gas ideale B. |
| | nB | Numero di moli del gas ideale B contenuto nel recipiente VB. |
| | 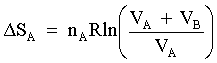 | Variazione di entropia connessa alla trasformazione. |
| | 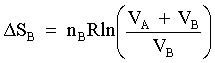 |
| | 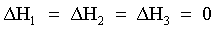 | Le interazioni tra le molecole, in un sistema gassoso ideale sono nulle. |
| | 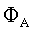 | Solubilità del gas A nel liquido B alla temperatura T. |
| (66) | 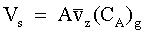
| 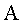 = superficie del liquido in contatto con la fase gassosa = superficie del liquido in contatto con la fase gassosa
| Velocità di solubilizzazione delle molecole del gas A nella soluzione |
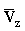 = componente lungo l'asse perpendicolare alla superficie A della velocità media delle molecole del gas A. = componente lungo l'asse perpendicolare alla superficie A della velocità media delle molecole del gas A.
|
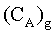 = concentrazione delle molecole del gas A nella fase gassosa. = concentrazione delle molecole del gas A nella fase gassosa.
|
| (67) | 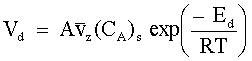
| 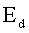 =energia necessaria per vincere le forze di attrazione tra le molecole del gas A e le molecole del liquido B. =energia necessaria per vincere le forze di attrazione tra le molecole del gas A e le molecole del liquido B.
| Velocità con cui le molecole fuoriescono dalla soluzione. |
| | 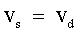 e e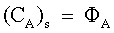
| Condizioni di equilibrio dinamico. | |
| | 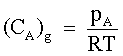 | 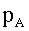 = pressione parziale del gas A nella fase gassosa. = pressione parziale del gas A nella fase gassosa.
| Concentrazione delle molecole del gas A nella fase gassosa. |
| (68) | 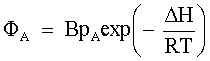 | 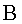 =costante. =costante.
| |
| (69) | 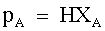 | | |
| | L1, L2 | Due liquidi in soluzione in un recipiente chiuso e completamente miscibili fra loro. | |
| (71) | 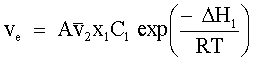 | | Velocità di evaporazione di L1 dalla soluzione. |
| (72) | 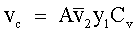 | | Velocità di condensazione di L1 dalla fase vapore. |
| | 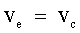 | | Condizioni di equilibrio. |
| (73) | 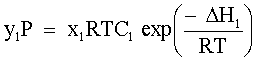 | P = tensione di vapore della soluzione. | |
| | 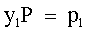 | p1 = pressione parziale di L1 nella fase vapore. | |
| (74) | 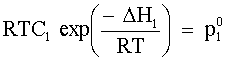 | 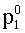 = tensione di vapore di L1 allo stato puro. = tensione di vapore di L1 allo stato puro.
| |
| (75) | 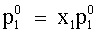 , ,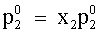 | | |
| (76) | 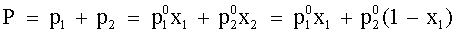 | Tensione di vapore P della soluzione. |