| E' una specie chimica capace di cedere un protone ad un'altra specie chimica. |
| Acido che contiene due protoni trasferibile per molecola (es.H2SO4, H2S). |
| Acido con più di un protone trasferibile per molecola. |
| Polo negativo. Elettrodo su cui avviene la semireazione di ossidazione. |
| Specie chimica capace di accettare un protone da un'altra specie chimica. |
| Consiste, scritti i reagenti ed i prodotti della reazione, nel fare in modo che il numero ed il tipo degli atomi presenti nei reagenti sia esattamente uguale al numero ed al tipo di atomi presenti nei prodotti. Bilanciare un'equazione di reazione significa determinare i coefficienti di reazione. |
| La variazione di entalpia dovuta alla reazione che dà origine ad una mole di composto a partire dagli elementi che lo costituiscono. |
| Calore svolto o assorbito nel corso di una reazione chimica. |
| Spazio che intercorre tra due urti successivi di una stessa particella. |
| Polo positivo. Elettrodo su cui avviene la semireazione di riduzione. |
| Sistema capace di produrre energia elettrica. E' caratterizzata dalle due coppie REDOX che danno origine alle reazione anodica ed alla reazione catodica. |
| Metodo per separare un sistema eterogeneo nelle fasi che lo costituiscono, fondato sulla differenza di densità sfruttando l'azione della forza centrifuga. |
| Studio delle velocità di reazione e la loro dipendenza dalle condizioni sperimentali. |
| Fattore che consente di valutare lo scostamento del comportamento ideale in funzione della pressione e della temperatura. |
| Intensità della corrente che circola nella soluzione tra due elettrodi di sezione unitaria posti a distanza unitaria sotto la differenza di potenziale di 1 Volt. |
| Coppia formata dalla forma ossidata e ridotta di una specie chimica. |
| Costante caratteristica di ciascuna reazione, per una certa temperatura. In generale, se reagiscono a molecole di A con b molecole di B ecc. per formare m molecole di M, n di N, ecc., secondo la reazione di equilibrio aA+bB+...=mM+nN+... l'espressione della costante è: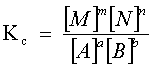
|
| Temperatura alla quale la tensione di vapore del liquido uguaglia la pressione esterna. |
| Passaggio di un gas attraverso un piccolo foro di una parete sottile. |
| Velocità con un cui un gas effonde. E' proporzionale al numero di urti al secondo e quindi alla velocità quadratica media. |
| In una cella galvanica, elettrodo che funge da semplice conduttore e non partecipa direttamente alla semireazione (ad es., elettrodo ad idrogeno H+/H2). |
| Elettroni responsabili dell'attività chimica di ciascun elemento cioè dell'interazione con altri atomi. |
| Energia necessaria ad allontanare completamente un elettrone da un atomo isolato. |
| |
| Qualunque parte di un sistema omogeneo e fisicamente distinta dalle altre parti. |
| Metodo per separare un sistema eterogeneo nelle fasi che lo costituiscono, basato sulla differenza di dimensioni delle particelle che costituiscono le fasi: il sistema passa attraverso un materiale poroso che funziona da filtro.. |
| Differenza di potenziale che si viene a creare fra due elettrodi di una cella galvanica e che genera un flusso di elettroni dall'anodo al catodo. Dipende anche dalla temperatura e dalle concentrazioni delle specie in soluzione. |
| Elementi costituiti da atomi senza elettroni di valenza e che quindi non hanno alcuna attività chimica. |
| |
| Relazione matematica che permette di valutare il peso molecolare incognito di un gas rapportando la sua velocità di effusione a quella di un gas di peso molecolare noto. |
| A temperatura costante, la concentrazione di un gas debolmente solubile in un liquido (cioè la massa o il numero di moli di un gas che si scioglie in un dato volume di un liquido) è direttamente proporzionale alla pressione parziale del gas. |
| La variazione di entalpia connessa ad una trasformazione chimica o fisica è pari alla somma delle variazioni di entalpia dei singoli stadi attraverso i quali avviene o si immagina possa avvenire la reazione stessa. |
| Legge strettamente valida per soluzioni ideali (o quasi ideali) che mette in relazione, a temperatura costante, il valore della pressione di vapore di una soluzione con la composizione di questa e con i valori della pressione di vapore delle singole specie che la costituiscono. Per una soluzione costituita da due componenti, la legge è espressa dalla relazione: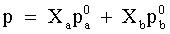 . .
La composizione della fase vapore in equilibrio con una soluzione è diversa da quella della soluzione stessa (salvo il caso particolare di soluzioni in cui: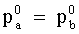
|
| Numero di moli (ni) di un soluto (i) contenuti in 1000 g di solvente. |
| Rapporto fra il numero di moli (ni) del componente (i) ed il numero di moli totali presenti in soluzione. |
| Numero di moli (ni) di un soluto (i) contenuti in un litro di soluzione. Poiché il volume varia con la temperatura, a temperature diverse corrispondono valori diversi di M. |
| Relazione che mostra come il potenziale di elettrodo di una generica coppia redox sia in funzione delle concentrazioni della forma ossidata e della forma ridotta ciascuna elevata ad un esponente pari al coefficiente di reazione. |
| I tre numeri che caratterizzano ogni orbitale. |
| Definisce il senso del moto dell'elettrone intorno al proprio asse. |
| Indica l'orientamento dell'orbitale rispetto a tre assi cartesiani arbitrariamente scelti. |
| Indica il livello energetico cui appartiene l'orbitale. Può assumere solo valori interi positivi (1, 2, 3, ...) e dà un'idea approssimata della distanza dell'elettrone dal nucleo. |
| Specifica la forma spaziale dell'orbitale. Può assumere valori interi compresi tra 0 ed (n-1) dove. n=numero quantico principale. |
| Superficie chiusa che racchiude il volume di spazio nel quale la probabilità di trovare l'elettrone è circa il 90%. |
| Trasformazione chimica nella quale vengono perduti elettroni da un atomo o da un gruppo di atomi. |
| Fenomeno per cui atomi neutri con elettroni spaiati subiscono l'effetto di un campo magnetico. |
| Numero di grammi di un componente in 100 g di soluzione. |
| Numero di litri di un componente contenuti in 100 l di soluzione. |
| Cella galvanica formata da due elettrodi dello stesso metallo M immersi in due soluzioni contenenti lo stesso ione M+n ma a due concentrazioni diverse. |
| (Potenziale di elettrodo standard). Si calcola misurando la f.e.m. di una cella galvanica formata dalla coppia in esame e dalla coppia H+/H2 in condizioni standard. |
| Temperatura alla quale il solido ed il liquido coesistono in equilibrio col vapore. |
| Quantità di energia liberata da un elettrone passando da un livello energetico a quello più vicino a più bassa energia. |
| Processo per cui, date alcune specie chimiche, A, B, dette reagenti, queste interagiscono tra di loro trasformandosi in specie chimiche diverse X, Y, dette prodotti della reazione. |
| Numeri (abitualmente si omette il numero 1) che, nelle equazioni di reazione, compaiono davanti ai simboli delle diverse specie chimiche. |
| Variazione, nell'unità di tempo, del numero di moli di un reagente o di un prodotto. |
| Trasformazione chimica nella quale vengono acquistati elettroni da un atomo o da un gruppo di atomi. |
| Metodo per separare un sistema eterogeneo nelle fasi che lo costituiscono, fondato sulla differenza di densità sfruttando l'azione della forza di gravità. |
| Porzione qualsiasi di materia con caratteristiche e proprietà definite. |
| Sistema formato da più fasi. |
| Miscela di due o più sostanze diverse che costituiscono una sola fase. |
| Soluzione in cui è nulla l'entalpia di mescolamento. |
| Soluzione reale costituita da due o più sostanze le cui molecole hanno dimensioni e struttura molto simile. |
| In un processo elettrolitico in cui riduzione ed ossidazione comportano sviluppo di gas agli elettrodi, tensione addizionale necessaria per fare avvenire le reazioni di ossidoriduzione agli elettrodi. Dipende dalla natura dei gas e dalla natura dell'elettrodo. |
| In un processo elettrolitico, tensione che occorre per fare avvenire le reazioni di ossidoriduzione agli elettrodi. |
| Modello che permette di derivare da semplici considerazioni meccaniche una relazione tra la temperatura assoluta e l'energia cinetica media traslazionale che formano un sistema gassoso ideale. |